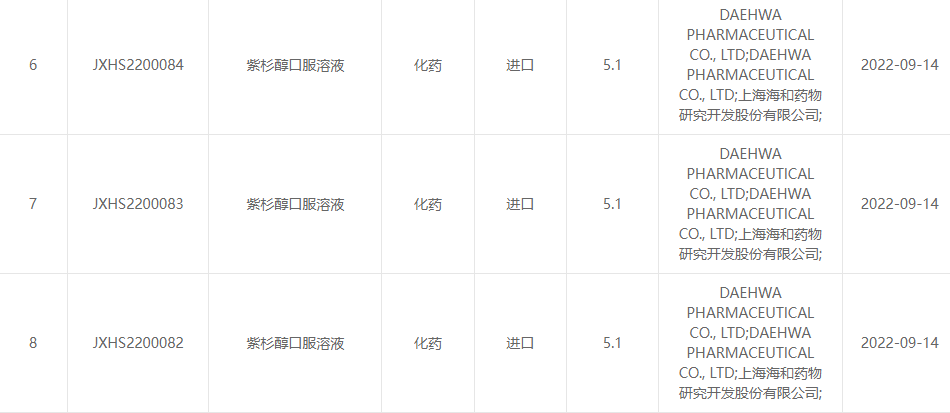
Le 13 septembre 2022, Shanghai Haihe Pharmaceutical Research and Development Co., Ltd. et Daehwa Pharmaceutical Co., Ltd. ont annoncé conjointement que la solution orale de paclitaxel (RMX3001) développée conjointement par les deux parties avait été officiellement approuvée par le Center for Drug Évaluation (CDE) de la State Drug Administration.(Numéro d'acceptation : pays JXHS2200082, pays JXHS2200083, pays JXHS2200084).
Source de l'image : Administration nationale des médicaments
Paclitaxelest largement utilisé dans le traitement de diverses tumeurs malignes telles que le cancer du poumon, le cancer du sein, le cancer des ovaires, le cancer de la tête et du cou et le cancer gastrique.Polymérisation des protéines, assemblage des microtubules, empêchant la dépolymérisation, stabilisant ainsi les microtubules et inhibant la mitose des cellules cancéreuses et déclenchant l'apoptose, empêchant ainsi efficacement la prolifération des cellules cancéreuses et jouant un effet anticancéreux.
À l’heure actuelle, la plupart des régions du monde utilisent le paclitaxel sous forme d’injection, qui doit être formulé et administré par perfusion intraveineuse à l’hôpital.Les patients doivent retourner fréquemment à l'hôpital et des effets indésirables se produiront au site d'injection.Par conséquent, le développement de préparations orales de paclitaxel a toujours été un point chaud dans la recherche industrielle..
RMX3001 est une formulation orale de paclitaxel développée par Dahua Pharmaceutical sur la base de sa technologie innovante d'administration de médicaments auto-émulsifiants lipidiques.Il a été approuvé par la Korean Food and Drug Administration en septembre 2016 (nom commercial Liporaxel) et son indication est le traitement avancé ou de deuxième intention du cancer gastrique métastatique ou du cancer gastrique localement récurrent.Selon un communiqué de presse de Haihe Pharmaceuticals, le Liporaxel est le premier produit oral à base de paclitaxel qui a été développé avec succès et dont la commercialisation a été approuvée dans le monde à ce jour.En septembre 2017, Haihe Pharmaceutical a obtenu auprès de Dahua Pharmaceuticals les droits de R&D, de production et de vente du produit en Chine continentale, à Hong Kong, à Taiwan et en Thaïlande.
La demande d'inscription du RMX3001 en Chine repose principalement sur un essai clinique de non-infériorité randomisé, ouvert, contrôlé en parallèle et multicentrique de phase 3, qui vise à comparer le traitement de deuxième intention de la solution orale de paclitaxel RMX3001 et paclitaxel injectable (Taxol) Efficacité et sécurité chez les patients atteints d'un cancer gastrique avancé.L'étude a été menée conjointement par le professeur Li Jin de l'hôpital oriental de Shanghai et le professeur Qin Shukui de l'hôpital Jinling de Nanjing en tant qu'investigateurs principaux.
Le Dr Ruiping Dong, PDG de Haihe Pharmaceuticals, a déclaré : « L'acceptation de la demande de solution buvable de paclitaxel (RMX3001) est une autre étape importante pour Haihe Pharmaceuticals, et je suis très reconnaissant envers les enquêteurs cliniques et les patients qui ont participé à notre étude. procès.Cancer gastrique avancé Il existe encore un énorme besoin clinique de traitement non satisfait, et nous espérons apporter dès que possible les traitements les plus innovants et les plus pratiques au monde aux patients en Chine et dans le monde entier.
Yunnan Hande Biotechnology Co., Ltd. se concentre sur la production de paclitaxel depuis 28 ans.Il s'agit du premier fabricant indépendant au monde du paclitaxel, un médicament anticancéreux d'origine végétale qui a été approuvé par la FDA américaine, l'EDQM européenne, la TGA australienne, la CFDA chinoise, l'Inde, le Japon et d'autres agences de réglementation nationales.entreprise.Si vous voulez acheterAPI Paclitaxel,veuillez nous contacter en ligne.
Heure de publication : 14 septembre 2022